
一种混合微流控系统,能够捕获单细胞在皮升级的液滴中,从而可以分选和恢复单个克隆细胞以建立稳定的多克隆细胞系。
Introduction
CRISPR‐Cas9已经成为制造新细胞系的著名工具,可以进行新的细胞治疗与建立新的癌症基因模型。要制造这些新的基因编辑细胞系,评估单克隆的属性尤为重要,因为可能会出现双等位基因编辑差异,并且非同源末端连接的细胞双链断裂(DSB)修复机制会产生单克隆之间存在差异的插入和缺失。分离单克隆可以富集正确编辑的细胞,该方法可以将表型变化与特定的克隆基因型相关联,并有助于下游表征。
当前哺乳动物基因编辑流程中,转染克隆的选择和富集,特别是在敲除实验中,敏感细胞系(例如人多能干细胞h)或难以转染的细胞系,仍然是繁琐而富挑战性的任务。传统的液滴微流控技术的缺点是很难并行操纵和控制液滴。数字微流控(DMF)可以缓解液滴在通道系统的相关挑战,因为DMF能够单独处理每个液滴。
本文建立了一个确定性的“单液滴单细胞”的混合微流控系统,可以捕获单个单克隆细胞并后续在独立的液滴中操纵。为了展示这个装置的通用性,作者以NCI-H1299肺鳞状细胞癌的基因敲除细胞系的建立举例。
Figure 1. Integrated “hybrid” microfluidic device for on-demand single-cell encapsulation and analysis
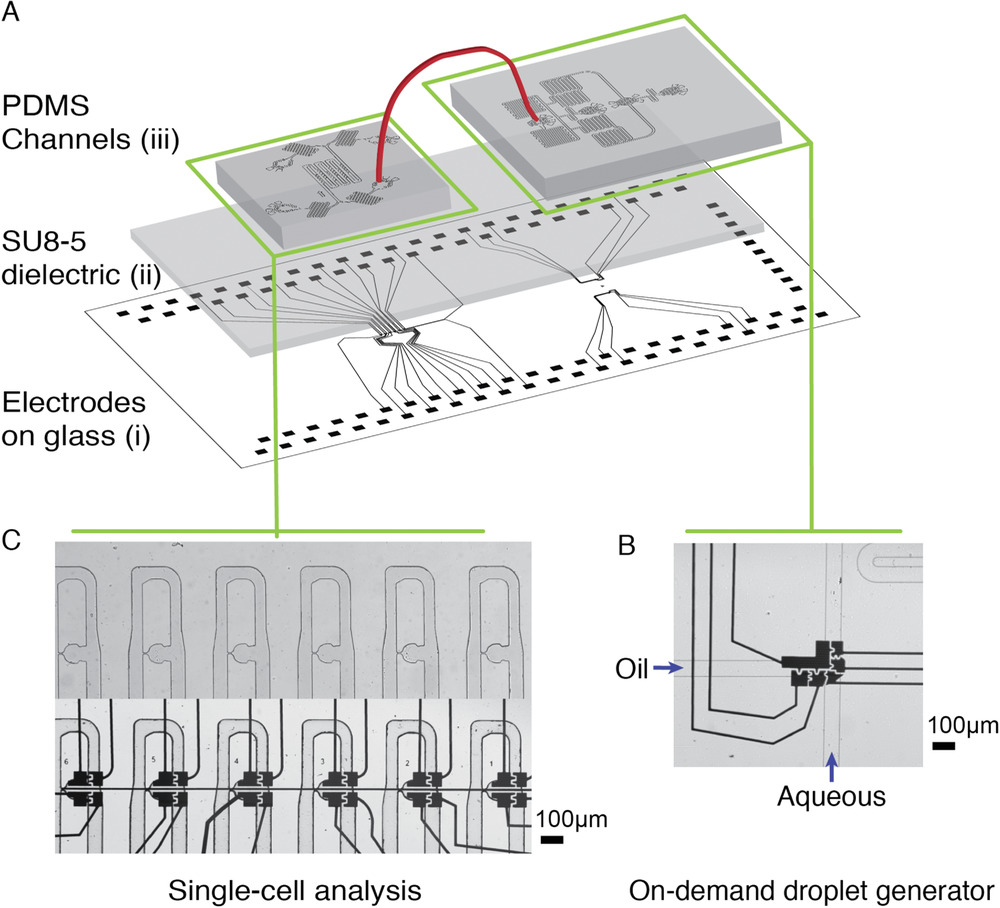
- (A)该三层设备包括一个玻璃上的铬电极图案的数字微流体层和一个7 µm厚的SU-8 5绝缘层以及一个PDMS通道层,其通道高度为35 µm,宽度为50-75 µm。
- (B)液滴生成装置包含了2个T型液滴生成器,其中一些电极位于下面以生成需要的液滴。
- (C)单细胞分析装置包含了2个进水口和2个出水口。捕获区包含8 µm收缩的细胞捕获孔,其下方有4个电极。
辅助材料里的装置图:
关于液滴生成机制,参考Sauzade的论文[2],帮助理解。
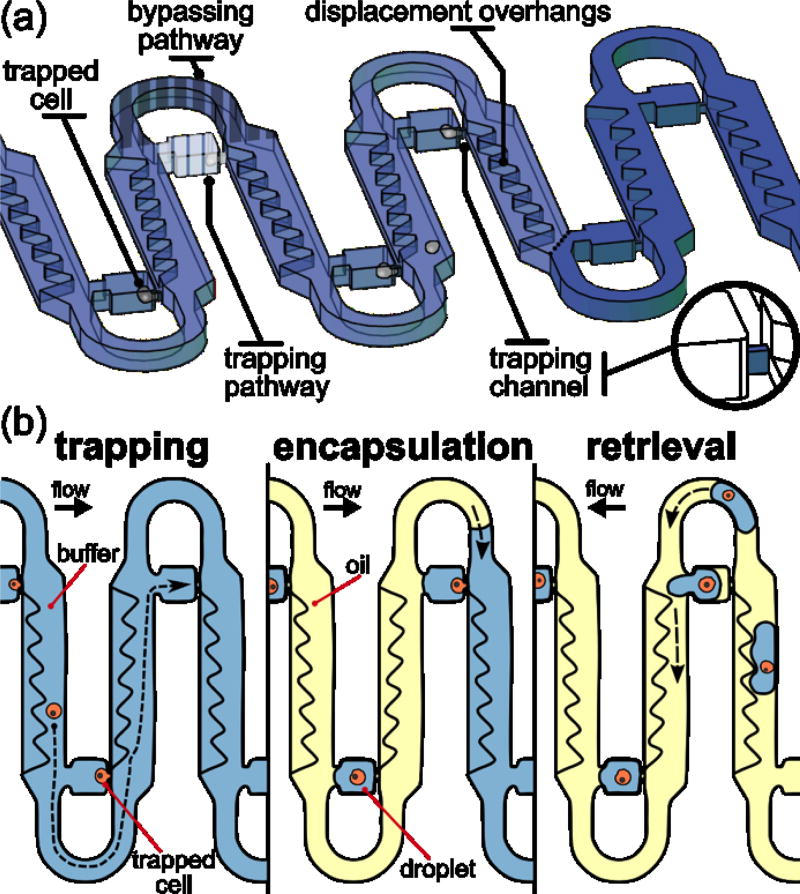
Figure 2. Workflow of device operation
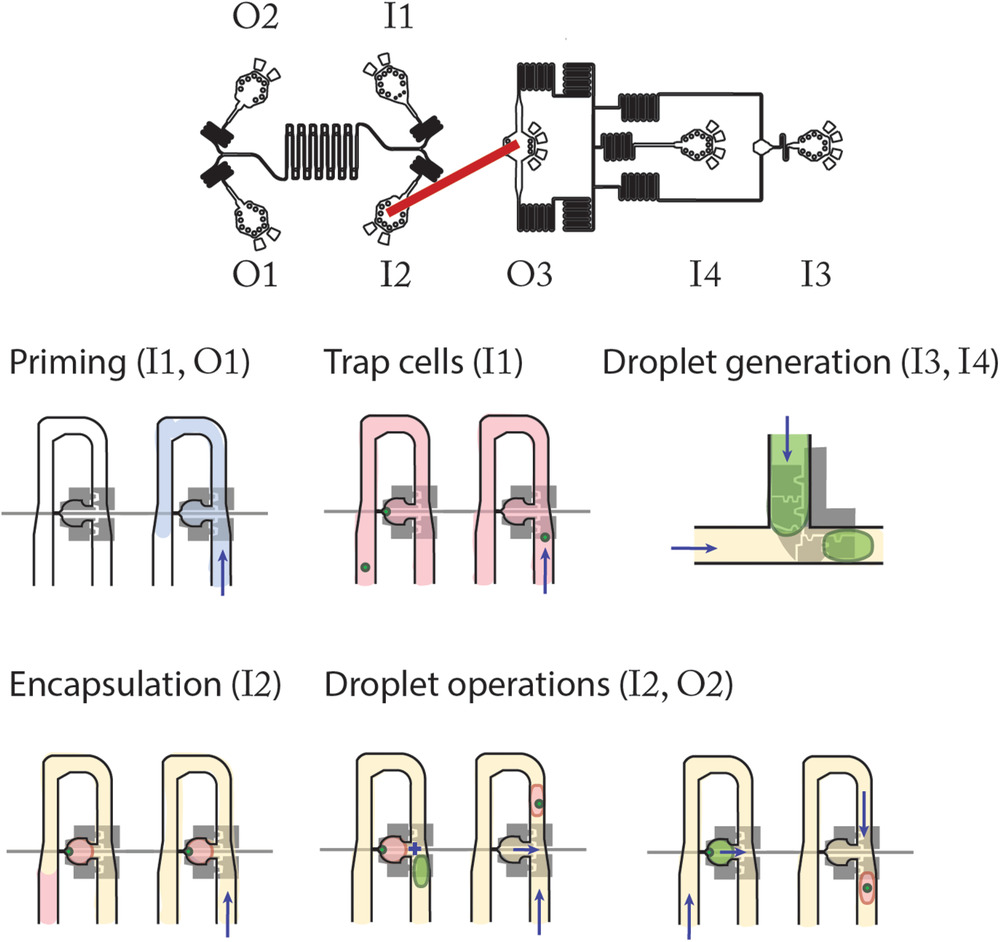
用含2% Pluronics F-127的PBS灌注设备5分钟。含MCF-7细胞的PBS在经过陷阱时被捕获,所有陷阱都有细胞后,以4 nL s-1加载油HFE 7500和2% Ran公司的表面活性剂,油流会剪切掉少量残留的PBS,从而在细胞周围形成液滴。可以执行各种液滴操作(捕获,释放,保持,合并)。可以逆转油流以收集油滴。入口(I#)和出口(O#)代表每次操作插入管道的位置。
MCF-7:乳腺癌细胞系
H1299:肺鳞状细胞癌
Figure 3. Cell trapping and encapsulation

- (A)单个MCF-7细胞被捕获在PBS。
- (B)不同流速有不同的捕获效率。其中PBS中细胞浓度被固定为5 × 105 cells mL−1。
- (C)封装过程。I:单个MCF-7细胞被捕获,HFE 7500和2% 表面活性剂以4 nL s-1的流速载入装置。陷阱电极被驱动(15 kHz,126 VRMS)。II:随着油相连续通过旁路通道,液滴生成在陷阱里。III:被封装的单个MCF-7细胞。
Figure 4. On-demand droplet operations

驱动模式用红点表示。
- (*)旁路通道、陷阱和流量如图所示。
- (A)使用按需功能(15 kHz,126 VRMS)将液滴释放到出口。
- (B)前向流速下的液滴释放效率。
- (C)使用按需功能(15 kHz,126 VRMS)将液滴释放到入口。
- (D)反向流速下的液滴释放效率。在流体动力学上,随着流速增加,液滴向入口释放效率越高。按需释放上,液滴有着完美的表现而于流速无关。
- (E)反向流速下,使用按需功能(15 kHz,126 VRMS,10 s)将液滴保持在陷阱里。
- (F)反向流速下,按需保持液滴的效率。当流速低于45.4 nL s-1时,液滴将有效率的被保持。
Figure 5. Viability assay of MCF-7 cells

- (A)上图为被捕获的MCF‐7细胞在装置上孵育10分钟后;下图为电极驱动30 s (15 kHz,126 VRMS),装置上孵育10分钟后。均经FDA/PI染色。FDA染色显示活细胞,PI染色显示死细胞。
- (B)细胞存活率图显示,对照组(87.5±7.2%)和电极驱动后(82.5±8.1%)的细胞存活率无显著差异。
Figure 6. Gene-editing pipeline: screening and sorting edited H1299 isoclones

- (A)设计含有Cas9基因的质粒,mCherry报告基因和靶向eGFP或RAF1的sgRNA(向导RNA)。
- (B)流式细胞术显示了转染效率。
- (C)通过基因组裂解检测分析进行敲除确认,eGFP和RAF1的敲除效率分别为4.95%和8.3%
- (D)捕获由脂质介导的转染产生的H1299细胞(eGFP +),并筛选mCherry表达(红色)。被困细胞显示成功表达mCherry(红色)和GFP(绿色)(陷阱3)的转染细胞和仅表达天然GFP(绿色)(陷阱2)的细胞。
- (E)转染的isoclone被封装,随后按需向出口释放。
- (F)包含已敲除的细胞的液滴被出口收集,转移到毛细管,在96孔板中恢复。两张图片显示了在第5天和第7天GFP敲除isoclonal细胞的扩增。mCherry报告基因仅在第1天显示,因为它在第2或3天后会因为细胞分裂而丢失。
细胞转染是指将外源核酸物质(DNA或者RNA)输送至真核细胞内部的技术,以进行多种细胞生理和生化的研究,包括:代谢途径研究;基因表达调控;癌症&疾病模型相关研究以及重组蛋白研究。随着基因和蛋白功能研究的发展,细胞转染技术已经成为科研试验中最常用的技术手段之一。外源基因导入真核细胞主要有四种方法:磷酸钙法、电穿孔法、脂质体介导法和病毒介导法。
电穿孔法是利用高脉冲电压可逆地击穿细胞膜形成瞬时的小孔促使外源DNA分子进入细胞内,适合所有类型的细胞,但细胞致死率高,DNA和细胞用量大,且需根据不同细胞类型优化电穿孔条件。
磷酸钙法是利用细胞内吞作用将磷酸钙介导共沉淀的磷酸钙-DNA复合物纳入细胞中的方法。该方法可用于瞬时或稳定转染,但对pH、温度和缓冲盐溶液浓度的微小变化十分敏感,导致该方法可重复差。且磷酸钙法对许多类型的细胞(尤其是原代细胞)具有细胞毒性,转染效率较差。
病毒介导法通过侵染宿主细胞将外源基因整合到宿主染色体中,可用于难转染细胞、原代细胞和稳定性转染,也可用于蛋白质过表达或抑制,是临床研究中常用的方法之一。但是病毒介导法对插入的目的片段长度有一定的限制,技术难度比较高,而且某些病毒起效时间比较慢,跟不上细胞快速繁殖的速度。单纯用于简单细胞系的转染,其性价比不高。
脂质体介导法利用带正电的脂质体与核酸带负电的磷酸基团形成复合物,被表面带负电的细胞膜吸附,进而通过融合或细胞内吞作用导入外源DNA/RNA。脂质体转染适合用于把DNA转染入悬浮或贴壁培养的细胞中,其转染效率高,是目前实验室最方便的转染方法之一。

Conclusion
作者建立了一个三层的混合微流控装置,不仅可以有效捕获单细胞及确定性封装,而且通过相变和电极驱动,可以将单相的包含细胞的水流转变为基于液滴的两相流体。接下来,展示了有效的液滴可控性,并充分表征了液滴产生,双向释放和保持的效率。并且所有这些操作都可以通过“单击按钮”以自动化执行。
Question
1.右边的电极有什么用?
通过改变电势,影响水流,进而影响液滴生成大小。
2.液滴的作用?
在正文部分没有具体体现,但是作者表示有合并的潜在用处。
3.图1B是否画错?
我认为还是画错了!
Reference
[1] Samlali K, Ahmadi F, Quach A B V, et al. One Cell, One Drop, One Click: Hybrid Microfluidics for Mammalian Single Cell Isolation[J]. Small, 2020, 16(34): 2002400.
[2] Sauzade M, Brouzes E. Deterministic trapping, encapsulation and retrieval of single-cells[J]. Lab Chip, 2017, 17(13): 2186-2192.




